Os antigos dividiam as substâncias em dois grandes grupos: as que se assemelhavam ao vinagre, denominadas ácidos, e as semelhantes às cinzas de plantas, chamadas álcalis. Os álcalis eram substâncias detergentes ou, segundo o farmacêutico e químico francês Guillaume François Rouelle, bases.
Existem muitas bases fracas e inofensivas no nosso cotidiano, dentre as muitas podemos citar o sabonete que faz muita espuma e desliza facilmente pela pele, pois, transforma alguns tipos de óleos de nossa pele em substâncias parecidas com as usadas para fazer sabão até compostos utilizados como medicamentos, como o hidróxido de magnésio e o hidróxido de alumínio. Por outro lado, existe também bases fortes e corrosivas tanto quanto os ácidos, como por exemplo: hidróxido de sódio utilizado em produtos para desentupir encanamentos, hidróxido de amônio componente de produtos de limpeza, etc.
Podemos listar aqui algumas das propriedades funcionais das bases, como:
→ Possuem sabor amargo ou cáustico (adstringente – que “amarra” a boca);
→ Modificam a cor dos indicadores ácido-base;
→ Conduzem a corrente elétrica quando fundidos ou em solução aquosa;
→ Reage com ácidos produzindo sal e água;
Na maioria das vezes são corrosivos e reagem com metais.CONCEITO DE BASE SEGUNDO ARRHENIUS

Ex.: NaOH 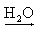 Na+(aq) + OH-(aq)
Na+(aq) + OH-(aq)
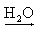 Na+(aq) + OH-(aq)
Na+(aq) + OH-(aq) Ca(OH)2 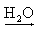 Ca2+(aq) + 2 OH-(aq)
Ca2+(aq) + 2 OH-(aq)
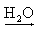 Ca2+(aq) + 2 OH-(aq)
Ca2+(aq) + 2 OH-(aq) Al(OH)3 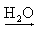 Al3+(aq) + 3 OH-(aq)
Al3+(aq) + 3 OH-(aq)
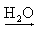 Al3+(aq) + 3 OH-(aq)
Al3+(aq) + 3 OH-(aq) Como pudemos observar, a principal característica das bases é a presença do íon OH- (hidroxila) ligado ao cátion que é um metal, sendo sua fórmula representada por:
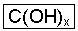
Onde: C à cátion (metal)
X à nº de hidroxilas que invertido de baixo para cima à esquerda, corresponderá à carga do metal.
Com isso na dissociação da base genérica C(OH)x ficaremos com:
C(OH)x Cx+ + X OH-
Exemplos:
NaOH 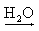 Na+(aq) + OH-(aq)
Na+(aq) + OH-(aq)
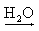 Na+(aq) + OH-(aq)
Na+(aq) + OH-(aq) Ca(OH)2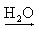 Ca2+(aq) + 2 OH-(aq)
Ca2+(aq) + 2 OH-(aq)
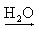 Ca2+(aq) + 2 OH-(aq)
Ca2+(aq) + 2 OH-(aq) Al(OH)3 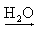 Al3+(aq) + 3 OH-(aq)
Al3+(aq) + 3 OH-(aq)
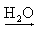 Al3+(aq) + 3 OH-(aq)
Al3+(aq) + 3 OH-(aq) Sn(OH)4 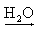 Sn4+(aq) + 4 OH-(aq)
Sn4+(aq) + 4 OH-(aq)
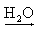 Sn4+(aq) + 4 OH-(aq)
Sn4+(aq) + 4 OH-(aq)Observação:
O hidróxido de amônio (NH4OH) é a única base que não apresenta metal em sua fórmula sendo proveniente do borbulhamento da amônia (NH3) em água:
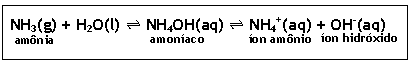
CLASSIFICAÇÃO DAS BASES
Ø Quanto ao número de hidroxilas na fórmula da base
· Monobase → uma hidroxila na fórmula da base.
Ex.: NaOH, KOH, AgOH, etc.
· Dibase → duas hidroxilas na fórmula da base.
Ex.: Ca(OH)2, Mg(OH)2, Zn(OH)2, etc.
· Tribase → três hidroxilas na fórmula da base.
Ex.: Al(OH)3, Fe(OH)3, Mn(OH)3, etc.
· Tetrabase → quatro hidroxilas na fórmula da base.
Ex.: Mn(OH)4, Sn(OH)4, Pb(OH)24, etc.
Ø Quanto a solubilidade das bases em água
· Totalmente solúveis → bases de metais alcalinos (1A) e o hidróxido de amônio (NH4OH).
· Parcialmente solúveis → bases de metais alcalinos terrosos (2A).
· Praticamente insolúveis → bases dos demais metais.
Exceção: O Be(OH)2 e Mg(OH)2 (bases da família 2A) são praticamente insolúveis.
Ø Quanto ao grau de dissociação (força das bases)
Para que uma base se dissocie é necessário que esta base esteja dissolvida em água, com isso teremos:

Exceção: O hidróxido de amônio (NH4OH) é uma base solúvel, mas que apresenta um pequeno grau de ionização, desta forma, esta base é classificada como solúvel e fraca.
Resumindo teremos:
· Bases fortes → bases dos metais da família 1A e 2A.
· Bases fracas → bases dos demais metais, Be(OH)2, Mg(OH)2 e NH4OH.
Ø Quanto a volatilidade das bases
· Base volátil → o hidróxido de amônio (NH4OH) é a única base volátil (baixo ponto de ebulição).
· Bases fixas → todas as demais bases são consideradas não voláteis ou fixas (alto ponto de ebulição).
NOMENCLATURA DAS BASES
Ø Para cátions que formam uma única base:

Os cátions que formam uma única base são: metais da família 1A e 2A, Ag+, Zn2+, Al3+ e NH4+ (amônio).
Exemplos:
NaOH → hidróxido de sódio
AgOH → hidróxido de prata
Ca(OH)2 → hidróxido de cálcio
Zn(OH)2 → hidróxido de zinco
Al(OH)3 → hidróxido de alumínio
NH4OH → hidróxido de amônio
Para montar a fórmula da base a partir dos nomes, é necessário sabermos que na formulação das base C(OH)x, o número de hidroxilas da base (X) dependerá da carga do cátion (C). Desta forma, teremos: cátions com carga +1 à 1 OH na fórmula; cátions com carga +2 à 2 OH na fórmula e cátions com carga +3 à 3 OH na fórmula.
Exemplos:
Hidróxido de potássio → K+ = KOH
Hidróxido de magnésio → Mg2+ = Mg(OH)2
Hidróxido de alumínio → Al3+ = Al(OH)3
Hidróxido de amônio → NH4+ = NH4OH
Hidróxido de zinco → Zn2+ = Zn(OH)2
Hidróxido de prata → Ag+ = AgOH
Para cátions que formam mais de uma base:
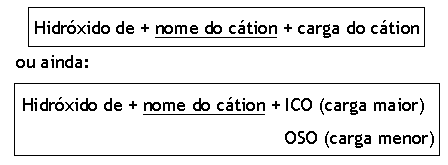
Os cátions, mais importantes, que formam duas bases são:
AuOH → hidróxido de ouro-I ou auroso
Au(OH)3 → hidróxido de ouro-III ou aúrico
CuOH → hidróxido de cobre-I ou cuproso
Cu(OH)2 → hidróxido de cobre-II ou cúprico
Fe(OH)2 → hidróxido de ferro-II ou ferroso
Fe(OH)3 → hidróxido de ferro-III ou férrico
Pb(OH)2 → hidróxido de chumbo-II ou plumboso
Pb(OH)4 → hidróxido de chumbo-IV ou plúmbico
APLICAÇÕES DAS PRINCIPAIS BASES DO COTIDIANO
Ø Hidróxido de sódio – NaOH
· Base conhecida como “soda cáustica” ou “lixívia” ou "diabo verde". É a base mais importante da indústria e do laboratório. É fabricado e consumido em grandes quantidades;
· Utilizado em produtos para desentupir ralos, pias e limpa forno;
É usado na fabricação do sabão. Atualmente, o sabão é obtido de gorduras (de boi, de porco, de carneiro, etc) ou de óleos (de algodão, de vários tipo de palmeiras, etc.). A hidrólise alcalina de glicerídeos (óleos ou gorduras) é denominada, genericamente, de reação de saponificação porque, numa reação desse tipo, quando é utilizado um éster proveniente de um ácido graxo, o sal formado recebe o nome de sabão. A equação abaixo representa genericamente a hidrólise alcalina de um óleo ou de uma gordura:
É usado em inúmeros processos industriais na petroquímica e na fabricação de papel, celulose, corantes, etc. É muito corrosivo e exige muito cuidado ao ser manuseado.
· Não existe soda cáustica livre na natureza, é fabricado por eletrólise (decomposição por corrente elétrica) de solução aquosa de sal de cozinha (NaCl).
Ø Hidróxido de cálcio – Ca(OH)2
· Conhecido como cal hidratada ou cal extinta ou cal apagada;
· É utilizado na construção civil no preparo da argamassa, usada na alvenaria, e na caiação (pintura a cal) o que fazem os pedreiros ao preparar a argamassa.
Ø Hidróxido de magnésio – Mg(OH)2
· È um sólido branco muito pouco solúvel em água;
· Quando disperso em água, origina um líquido espesso, denominado de suspensão, que contém partículas sólidas misturadas à água denominado de leite de magnésia utilizado como laxante e antiácido.
2 HCl(aq) + Mg(OH)2(aq) → MgCl2(aq) + 2 H2O(l)
acidez estomacal antiácido
Ø Hidróxido de alumínio – Al(OH)3
· É um sólido gelatinoso insolúvel na água;
· Utilizado no tratamento da água. O hidróxido de alumínio formado na superfície, como um precipitado gelatinoso, arrasta as impurezas sólidas para o fundo do tanque, no processo denominado decantação;
Al2(SO4)3 + 3 Ca(HCO3)2 → 2 Al(OH)3 + 3 CaSO4 + 6 CO2
· Utilizado como medicamento com ação de antiácido estomacal (Pepsamar, Natusgel, Gelmax, etc) pois neutraliza o excesso de HCl no suco gástrico.
3 HCl(aq) + Al(OH)3(aq) → AlCl3(aq) + 3 H2O(l)
acidez estomacal antiácido
Ø Hidróxido de amônio – NH4OH
· É obtido através do borbulhamento de amônia(NH3) em água, originando uma solução conhecida comercialmente como amoníaco;
NH3(g) + H2O(l) 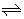 NH4OH(aq)
NH4OH(aq) 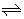 NH4+(aq) + OH-(aq)
NH4+(aq) + OH-(aq)
amônia amoníaco íon amônio íon hidróxido
· É utilizado em produtos de limpeza doméstica tais como: ajax, fúria, pato, veja, etc.
· É utilizado na fabricação de sais de amônio, empregados na agricultura e como explosivos.
Nenhum comentário:
Postar um comentário