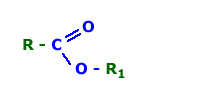
Éster
Na química orgânica e bioquímica, os ésteres constituem o grupo funcional (R´-COOR"), que consiste em um radical orgânico unido ao resíduo de qualquer ácido oxigenado, orgânico ou inorgânico.Um éster é o produto da reação de um ácido (geralmente orgânico) com um álcool (o hidrogênio do ácido R-COOH é substituído por um grupo alquilo R"). Os ésteres mais comuns que se encontram na natureza são as gorduras e os óleos vegetais, os quais são ésteres de glicerol e de ácidos graxos.
Os ésteres resultam freqüentemente da condensação (uma reação que produz água) de um ácido carboxílico e de um álcool. Ao processo dá-se o nome de esterificação.
Ésteres de ácidos orgânicos
Os ésteres são derivados de ácidos pela substituição do hidrogênio do ácido por um radical orgânico. São possíveis ésteres sulfurados (exemplo: acetil-CoA), ésteres de fosfato (ex: ATP), porém os mais importantes são os ésteres de ácidos carboxílicos. Alguns deles estão representados abaixo:- Exemplos:
Nomenclatura
- (Nome do ânion derivado do ácido substituindo o sufixo ICO por ATO) de (Nome do radical)
- CH3COO - CH3 → Acetato de metila ou etanoato de metila
- CH3 - CH2 - COO - CH2 - CH3 → propanoato de etila
- CH3 - COO - CH2 - CH2 - CH2 - CH3 → Etanoato de butila
- CH2 = C (CH3) - COO - CH3 → metil propenoato de metila, o monômero do acrílico (plástico).
Métodos de preparação
Esterificação
Os ésteres também podem ser preparados a partir da reação ácido (geralmente orgânico) com um álcool (o hidrogênio do ácido R-COOH é substituído por um grupo alquilo R") ou um cloreto ou anidrido de ácido com álcool ou fenol.Na prática, de uma maneira genérica, a velocidade das reações de esterificação é acelerada pela presença de íons H+, por isto, adiciona-se um pouco de HCl, por exemplo, que atuará como catalisador. Numa reação de esterificação nunca se obtém 100% de rendimento em éster e água, pois somente uma parte do álcool e do ácido reagem, obtendo-se um equilíbrio com as quatro espécies químicas: álcool, ácido carboxílico, éster e água.[1]
- CH3COOH + C2H5OH
 CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
Processo petroquímico
Obtenção de ésteres a partir da reação de ácidos com alcenos:Exemplo: Ácido propanóico + propeno → propanoato de isopropila
- CH3-CH2-COOH + CH2=CH-CH3 → CH3-CH2-COO-CH(CH3)-CH3
Propriedades
Físicas
- Em geral, líquidos voláteis,incolores, de odor agradável aqueles que apresentam massas moleculares menores.
- Líquidos viscosos, xaroposos e gordurosos aqueles que massas moleculares médias.
- Sólidos com aspecto de cera aqueles que apresentam as maiores massas moleculares.
- Praticamente não apresentam polaridade molecular.
- Insolúveis em água, entretanto, solúveis em álcool.
Químicas
Hidrólise
do Gr. hýdor, água + lýsis, dissolução:É uma reação química, em que um dos reagentes é a água. Através desta reação grandes moléculas como os lípidos, por exemplo, são decompostos em moléculas menores que os constituem:
É o processo inverso da esterificação, produzindo ácido e álcool:
- R-COO-R1 + HOH → R-COOH + HO-R1
Saponificação
É a reação de um éster com uma base originando um sal orgânico e um álcool.Exemplo: Etanoato de metila + NaOH → etanoato de sódio + álcool metílico
- CH3-COO-CH3 + NaOH → [CH3-COO][Na] + CH3-OH
A saponificação pode ser aplicada em:
- produção de flavorizantes para a produção de refrescos, doces, pastilhas, xaropes, balas e etc.
- produção de sabões;
- como medicamentos;
- produção de perfumes e cosméticos;
- na alimentação.
Eliminação
Os ésteres podem ser hidrolisados aos respectivos ácido e álcool, sendo o ácido transformado num sal e o álcool dissolvido em água suficiente.Ocorrência
Os ésteres são substâncias comuns na natureza. São encontrados:- Nos óleos e nas gorduras
- Nas essências de frutas, de madeiras e de flores.
- Nas ceras como a de carnaúba e a de abelhas.
- Nos fosfatídeos como os existentes no ovo e no cérebro.
Os ésteres essênciais de flores e frutas, normalmente constituídas de cadeias de carbono pequenas e médias (até 8 carbonos). Possuem aroma agradável e estão presentes em flores e frutos. São obtíveis artificialmente e empregadas em alimentos como refrigerantes, sorvetes, doces, balas e em xaropes diversos. Um exemplo é o formiato de etila (HCOOC2H5), empregada como extrato artificial para xaropes de groselhas, rum, etc.[1]
Determinados ésteres são usados isoladamente, como o acetato de amila, com forte aroma de banana (chamado, inclusive, comercialmente, de essência de banana. O acetato de octilo é uado como essência artificial de laranja. Outros são usados compostos com outras susbstãncias, para formular essências diversas, como o acetato de etila, que participa de formulações de essências artificiais de maçã, pera, framboesa, pêssego, groselha, etc.[1]
Os lipídios e gorduras.
As ceras orgânicas ou cerídeos.
Usos e aplicações
- Produção de flavorizantes para a produção de refrescos, doces, pastilhas, xaropes, balas, etc.
- Produção de sabões.
- Como medicamentos.
- Produção de perfumes e cosméticos.
- Na alimentação.
- Na produção de biocombustíveis.
- Verdade.
Sais de Ácidos Carboxílicos
São compostos orgânicos que derivam dos ácidos carboxílicos pela substituição do hidrogênio da hidroxila por um metal. Em sua nomenclatura, dá-se o sufixo ato ao nome da cadeia de origem (igual aos ésteres) seguido da preposição de e do nome metal. Os sais de ácidos carboxílicos de cadeia longa são denominados de sabões.Fórmula Geral:

Exemplo:
 etanoato de sódio
etanoato de sódio Anidrido de ácido carboxílico
Os anidridos de ácidos carboxílicos (ou anidridos carboxílicos) são compostos químicos orgânicos que têm a fórmula geral (RCO)2O (quando simétricos) ou R−CO−O−CO−R' (quando mistos ou assimétricos), respectivamente quanto a seus grupos acilo (RCO-) serem iguais ou diferentes, e formalmente são o produto de desidratação de duas moléculas de ácido carboxílico (ou uma se tem como formar-se intramolecularmente em um ácido dicarboxílico). Ao reagir com água (hidrólise) voltando a formar os ácidos carboxílicos iniciais.
- CH3C(O)OC(O)CH3 + H2O → 2 CH3COOH [1]

- C8H6O4 → C8H4O3 + H2O
Nomenclatura
Quando simétricos, anidrido alcanóico como anidrido propanóico (ou em casos especiais, como anidrido etanóico, também chamado de anidrido acético, (CH3CO)2O) e quando assimétricos, anidrido alcanóico (R) alcanóico (R') como anidrido acético propiônico (CH3C(O)OC(O)CH2CH3).Síntese
Anidridos de ácido são usualmente preparados pela desidratação dos ácidos correspondentes. As condições variam muito de ácido para ácido, mas o pentóxido de fósforo é um agente desidratante comumente usado em laboratório.- 2 CH3COOH → CH3C(O)OC(O)CH3 + H2O
Os anidridos de ácido também se produzem ao reagir um haleto de acilo (RCOX) com um carboxilato (R'COO-):
- RCOX + R'COONa → RCO-O-COR' + NaX
- CH3COCl + CH3COONa → CH3C(O)OC(O)CH3 + NaCl
O
/ \
HOOC(CH2)2COOH → O=C C=O + H2O (300 °C)
| |
CH2-CH2O anidrido maléico é preparado por oxidação aeróbica do butano, assim como também por oxidação do benzeno:- CH3CH2CH2CH3 + 3.5 O2 → C2H2(CO)2O + 4 H2O
Aplicações
As reações dos anidridos de ácido são similares a dos halogenetos de acilo, ao ser tanto o halogeneto (X-) como o carboxilato bons grupos salientes. A destacar, o anidrido acético que pode formar ésteres com fenóis, sendo útil na produção de medicamentos como o ácido acetilsalicílico (Aspirina).Reações
Anidridos de ácido são uma fonte de grupos acila reativos, e suas reações e usos relembram alguns dos haletos de acila. Em reações com substratos próticos, as reações disponibilizam iguais quantidades de produtos acelitados e ácido carboxílico:- RC(O)OC(O)R + HY → RC(O)Y + RCO2H
Anidridos de ácido tendem a ser menos eletrófilos que cloretos de acila, e somente um grupo acila é transferido por molécula de anidrido de ácido, o qual conduz a uma mais baixa eficiência atômica. O baixo custo, entretando, do anidrido acético o faz uma escolha preferencial para reações de acetilação. Além disso, o abandono dos clorocarbonos é preferida pela questão ambiental.
Anidridos de ácido importantes
O Anidrido acético é um produto químico de grande importância, preparado através da hidratação parcial de cetena ou pela carbonilação do acetato de metila. O anidrido de ácido cíclico anidrido maléico é usado em síntese orgânica como dienófilo na reação de Diels-Alder. Anidridos de ácido mistos (ou assimétricos), tais como anidrido acético propiônico, CH3C(O)OC(O)CH2CH3, são conhecidos. Um ou ambos grupos acila de um anidrido de ácido pode também ser derivado de um ácido sulfônico ou um ácido fosfônico. O anidrido misto 1,3-Bisfosfoglicerato é um intermediário na formação de ATP via glicólise.Análogos de enxofre
Enxofre pode substituir o oxigênio, tanto no grupo carbonila como na ponte. No primeiro caso, o nome do grupo acila é fechado entre parênteses para evitar ambiguidade no nome, ex. anidrico (tioacético), CH3C(S)OC(S)CH3. Quando dois grupos acila são ligados ao mesmo átomo de enxofre, o composto resultante é chamado um tioanidrido, e.g. tioanidrido acético, CH3C(O)SC(O)CH3.Cloreto de acila
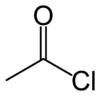
Em química orgânica, um cloreto de acila (ou cloreto ácido) é um composto orgânico o qual é um reativo derivado de um ácido carboxílico. Como parte de sua estrutura molecular, um cloreto de acila tem o grupo funcional reativo -CO-Cl. Um cloreto de acila tem a fórmula geral RCOCl aonde R é um grupo radical orgânico.Cloretos de acilas são um dentre os haletos de acila e intermediam muitos das reações químicas mencionadas em haleto de acila. Um exemplo específico de uma cloreto de acila é o cloreto de acetila (IUPAC name: ethanoyl chloride) CH3COCl.
Reações químicas
Cloretos de acila são muito reativos. A presença de cloro sobre o carbono da carbonila produz um eletrófilo muito bom, desde que tanto o oxigênio e cloro são fortemente removedores de elétrons, dando o carbono uma grande carga parcial positiva. Isto significa que um fraco nucleófilo pode atacar o carbono. Desde que um íon cloro é um bom grupo lábil, ele irá prontamente substituí-lo com o nucleófilo. Cloretos de acila podem ser usados para preparar qualquer derivado de ácido carboxílico: um anidrido de ácido, um éster ou uma amida por reagir um cloreto de ácido com: um sal de um ácido carboxílico, um álcool ou um reagente de Gilman (composto ditiorganocobre de lítio), respectivamente. Na maioria destas reações, HCl (cloreto de hidrogênio ou ácido clorídrico) é também formado do cloro no cloreto de acila combinando com um hidrogênio do reactante.De maneira geral:
- R-COCl + HO-H → R-COOH + HCl
Com carbonos nucleófilicos tais como os reagentes de de Grignard, cloretos de acila geralmente reagem primeiramente com a cetona e então com um seguinte equivalente a um álcool terciário. Uma notável exceção é a reação de haletos de acila com certos reagentes organocádmio os quais param no estágio cetona.
Cloreto de ácido de ácidos aromáticos são geralmente menos reatvos que ácidos de alquila e então algumas codições mais rigorosas são requeridas para a reação.
Cuidados
Porque os cloretos de acila são produtos tão reativos, eles são geralmente tóxicos e precauções especiais devem ser tomadas enquanto se os manuseia. Eles são substãncias lacrimogênicas porque podem reagir com água na superfície dos olhos produzindo ácido clorídrico e ácidos orgânicos irritando-os. Problemas similares podem resultar se inala-se vapores de cloretos de acila.Sínteses
Cloretos de acila são frequentemente preparados por reação de um ácido carboxílico com cloreto de tionila.- R-COOH + SOCl2 → R-COCl + SO2 + HCl
Cloretos de acila podem também ser preparados usando certos reagentes cloretos de fósforo, tais como o tricloreto de fósforo ou pentacloreto de fósforo:
- R-COOH + PCl5 → R-COCl + POCl3 + HCl
Nenhum comentário:
Postar um comentário