INTRODUÇÃO
A importância histórica do sal comum como conservante de alimentos e como moeda permaneceu em várias expressões de linguagem. A palavra salário, derivada do latim, representava originalmente a porção de sal que os soldados da antiguidade romana recebiam como pagamento por seus serviços.
Na linguagem vulgar, o termo sal designa estritamente o cloreto de sódio (NaCl), utilizado na alimentação. Em química, porém, tem um sentido muito mais amplo e se aplica a uma série de compostos com características bem definidas, que têm em comum o fato de se formarem pela reação de um ácido com uma base, através de uma reação denominada neutralização.
REAÇÃO DE NEUTRALIZAÇÃO
Observe o seguinte experimento:
Em um recipiente contendo solução aquosa de hidróxido de sódio (NaOH), adicionou-se o indicador fenolftaleína, observando-se uma coloração avermelhada.
Com o auxílio de um conta-gotas, adicionamos vinagre incolor a esta solução e observamos, após um certo tempo de gotejamento, que a solução fica incolor.
Qual a explicação para este fato?
Quando o vinagre (ácido acético) entrou em contato com a solução de hidróxido de sódio (NaOH), de alguma forma, o vinagre neutralizou o NaOH da solução.
Agora, vamos entender como isto ocorre.
Sabemos que o vinagre é constituído pelo ácido acético (CH3COOH) que sofre ionização segundo a equação:
CH3COOH → CH3COO-(aq) + H+(aq)
E o NaOH da solução sofre dissociação iônica conforme mostra a equação:
NaOH → Na+(aq) + OH-(aq)
Quando as soluções se misturam, ocorre a seguinte reação:
CH3COO-(aq) + H+(aq) + Na+(aq) + OH-(aq) → CH3COO-(aq) + Na+(aq) + H2O(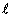 )
)
Como podemos observar, os íons CH3COO-(aq) e Na+(aq) permaneceram inalterados, não participando do processo, ou seja, não reagiram.
Com isso, a reação anterior fica assim equacionada:

Desta forma, a reação de neutralização se caracteriza, quando os íons H+ do ácido reagem com os íons OH- da base, formando água.
Agora que sabemos que na solução resultante temos os íons CH3COO-(aq), Na+(aq) e moléculas de H2O(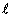 ), quando esta solução for aquecida e toda a água da solução for evaporada, teremos apenas os íons Na+ e CH3COO- que constituem a fórmula do sal chamado acetato de sódio.
), quando esta solução for aquecida e toda a água da solução for evaporada, teremos apenas os íons Na+ e CH3COO- que constituem a fórmula do sal chamado acetato de sódio.
Portanto podemos concluir que a reação entre um ácido e uma base, ou seja, uma neutralização, produz água e também pode ser obtido um sal.
Generalizando a reação de neutralização, ficamos com:
CONCEITO DE SAL
Ø CONCEITO TEÓRICO SEGUNDO ARRHENIUS

Exemplo: NaC ou Na+C-
Ø CONCEITO PRÁTICO

Exemplo:
HCl + NaOH → NaCl + H2O
Ácido Base Sal Água
NOMENCLATURA DOS SAIS
A nomenclatura dos sais é obtida a partir da troca do sufixo do ácido mais o nome do cátion proveniente da base.
| Sufixo do ácido | Sufixo do ânion |
| ÍDRICO | ETO |
| OSO | ITO |
| ICO | ATO |
Exemplo:
HCl + NaOH → NaCl + H2O
Ácido clorídrico hidróxido de sódio cloreto de sódio água
FORMULAÇÃO DE UM SAL
Para entendermos com um sal é formulado, vamos fazer a reação de neutralização entre um ácido genérico HYA e uma base genérica C(OH)X, onde A é o ânion do ácido e C é o cátion da base.
Antes de fazer a reação de neutralização, vamos rever como as cargas dos íons constituintes do ácido e da base estão dispostas:
Ø Para o ácido genérico HYA, invertendo-se o índice y, teremos a carga do ânion: AY-
Ø Para a base genérica C(OH)X, invertendo-se o índice X, teremos a carga do cátion: CX+
Desta forma, a reação de neutralização entre o ácido HYA e a base C(OH)X ficará:
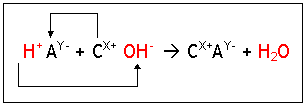
Com isso, o sal será representado genericamente assim:
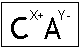
Para que a soma das cargas dos íons seja igual a zero, é necessário inverter as cargas dos íons e com isso obteremos o índice do cátion e do ânion, de modo que ao multiplicar o índice pela carga do respectivo íon, teremos soma igual a zero.
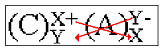
Resumindo temos:
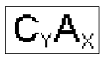
Onde:
C = cátion proveniente da base
A = ânion proveniente do ácido
Exemplos:
1º) Qual a fórmula do sal proveniente da reação entre o ácido fosfórico (H3PO4) e o hidróxido de cálcio (Ca(OH)2).
Primeiro vamos determinar as cargas dos íons:
Ø Para o ácido H3PO4, invertendo-se o índice 3, teremos a carga do ânion: PO43-
Ø Para a base Ca(OH)2, invertendo-se o índice 2, teremos a carga do cátion: Ca2+
Agora vamos juntar o cátion da base com o ânion do ácido:
Ca2+PO43-
Observe que a soma das cargas não é igual a zero, para que isto seja possível, vamos inverter as cargas e depois multiplicar o índice pela carga para cada íon:
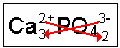
Multiplicando-se o índice pela carga do cátion temos +6 e multiplicando-se o índice pela carga do ânion temos -6, de modo que a soma das cargas ficou igual a zero. Desta forma, a fórmula do sal ficou assim representada:

2º) Qual a fórmula do sal proveniente da reação entre o ácido sulfúrico (H2SO4) e o hidróxido de magnésio (Mg(OH)2).
Primeiro vamos determinar as cargas dos íons:
Ø Para o ácido H2SO4, invertendo-se o índice 2, teremos a carga do ânion: SO42-
Ø Para a base Mg(OH)2, invertendo-se o índice 2, teremos a carga do cátion: Mg2+
Agora vamos juntar o cátion da base com o ânion do ácido:
Mg2+SO42-
Observe que a soma das cargas ficou igual a zero, e por isso, não se faz necessário inverter as cargas dos íons, e desta forma a fórmula do sal ficou assim representada:

BALANCEANDO AS EQUAÇÕES DE NEUTRALIZAÇÃO
Como vimos, a reação de neutralização é estabelecida quando ácido reage com base formando água e também sal. Equacionando a reação de neutralização, ficamos com:
ÁCIDO + BASE → SAL + ÁGUA
Onde:
ácido e base são os reagentes
Sal e água são os produtos
Segundo a Lei da Conservação das Massas, introduzida por Lavoisier em 1774, estabelecia que: “numa reação química, a soma das massas dos reagentes é igual à soma das massas dos produtos.”
Com isso, deduzimos que o número de átomos de um determinado elemento dos reagentes tem que ser igual ao número de átomos deste mesmo elemento dos produtos.
Ø NEUTRALIZAÇÃO TOTAL X NEUTRALIZAÇÃO PARCIAL
· Neutralização total
Neste caso os íons H+ do ácido são totalmente neutralizados pelos íons OH‑ da base formando água e um sal normal.
Exemplos:
a) Equacione a neutralização entre o ácido sulfúrico (H2SO4) e o hidróxido de alumínio (Al(OH)3).
1º Passo: determinar a carga do cátion da base e do ânion do ácido
H2SO4 = SO42-
Al(OH)3 = Al3+
2º Passo: fazer a reação entre o ácido e a base formando o sal e mais água
H2SO4 + Al(OH)3 → Al3+SO42- + H2O
3º Passo: inverter as cargas dos íons do sal para que a soma se anule
H2SO4 + Al(OH)3 → Al2(SO4)3 + H2O
Observe que temos um número de átomos nos reagentes diferente do número de átomos nos produtos, e neste caso deveremos iniciar o balanceamento da reação, para que o número de átomos dos reagentes e dos produtos se iguale.
4º Passo: Parte-se de 1 composto do sal formado.
H2SO4 + Al(OH)3 → 1 Al2(SO4)3 + H2O
5º Passo: acerta-se o número de átomos do metal alumínio
H2SO4 + 2 Al(OH)3 → 1 Al2(SO4)3 + H2O
6º Passo: acerta-se o número de átomos do ametal enxofre
3 H2SO4 + 2 Al(OH)3 → 1 Al2(SO4)3 + H2O
7º Passo: acerta-se o número de átomos de hidrogênio
3 H2SO4 + 2 Al (OH)3 → 1 Al2(SO4)3 + 6 H2O
ác. sulfúrico hidróxido de sulfato de alumínio
alumínio
Se os coeficientes estiverem corretos, o número de átomos de oxigênio fica automaticamente balanceado.
Verificando o número de átomos dos reagentes e dos produtos após o balanceamento da reação:
| Elemento | Nº de átomos Reagentes | Nº de átomos Produtos |
| Alumínio | 2 | 2 |
| Enxofre | 3 | 3 |
| Hidrogênio | 12 | 12 |
| Oxigênio | 18 | 18 |
a) Equacione a neutralização entre o ácido fosfórico (H3PO4) e o hidróxido de bário (Ba(OH)2).
1º Passo: determinar a carga do cátion da base e do ânion do ácido
H3PO4 = PO43-
Ba(OH)2= Ba2+
2º Passo: fazer a reação entre o ácido e a base formando o sal e mais água
H3PO4 + Ba(OH)2 → Ba2+PO43- + H2O
3º Passo: inverter as cargas dos íons do sal para que a soma se anule
H3PO4+ Ba(OH)2 → Ba3(PO4)2 + H2O
Observe que temos um número de átomos nos reagentes diferente do número de átomos nos produtos, e neste caso deveremos iniciar o balanceamento da reação, para que o número de átomos dos reagentes e dos produtos se iguale.
4º Passo: Parte-se de 1 composto do sal formado.
H3PO4 + Ba(OH)2 → 1 Ba3(PO4)2 + H2O
5º Passo: acerta-se o número de átomos do metal bário
H3PO4 + 3 Ba(OH)2 → 1 Ba3(PO4)2 + H2O
6º Passo: acerta-se o número de átomos do ametal fósforo
2 H3PO4 + 3 Ba(OH)2 → 1 Ba3(PO4)2 + H2O
7º Passo: acerta-se o número de átomos de hidrogênio
2 H3PO4+ 3 Ba(OH)2 → 1 Ba3(PO4)2 + 6 H2O
ác. fosfórico hidróxido de fosfato de bário
bário
Se os coeficientes estiverem corretos, o número de átomos de oxigênio fica automaticamente balanceado.
Verificando o número de átomos dos reagentes e dos produtos após o balanceamento da reação:
| Elemento | Nº de átomos Reagentes | Nº de átomos Produtos |
| Bário | 3 | 3 |
| Fósforo | 2 | 2 |
| Hidrogênio | 12 | 12 |
| Oxigênio | 14 | 14 |
· Neutralização parcial
Neste caso sobram íons H+ do ácido ou íons OH- da base sem ser neutralizados formando água e um hidrogeno sal ou um hidróxi sal.
Exemplos:
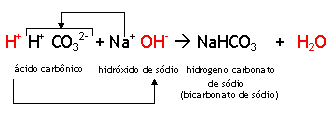
a) Equacione a neutralização entre uma molécula de ácido carbônico (H2CO3) e uma molécula de hidróxido de sódio (NaOH).
Montando a reação química, temos:
1 H2CO3 + 1 NaOH →
Observe que na neutralização parcial, os reagentes já estão balanceados. Neste caso a melhor opção para fazer a reação é através da neutralização dos íons H+ do ácido com os íons OH- da base:
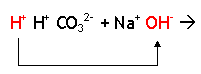
Como você observou, restou um íon H+ do ácido sem ser neutralizado. Após a neutralização, juntamos o cátion da base com o que sobrou do ácido e desta forma temos a fórmula do sal, classificado como hidrogeno sal.
b) Equacione a neutralização entre uma molécula de ácido nítrico (HNO3) e uma molécula de hidróxido de cálcio (Ca(OH)2).
Montando a reação química, temos:
1 HNO3 + 1 Ca(OH)2 →
Observe que na neutralização parcial, os reagentes já estão balanceados. Neste caso a melhor opção para fazer a reação é através da neutralização dos íons H+ do ácido com os íons OH- da base:
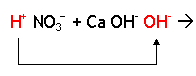
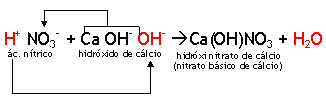
Como você observou, restou um íon OH- da base sem ser neutralizado. Após a neutralização, juntamos o ânion do ácido com o que sobrou da base e desta forma temos a fórmula do sal, classificado como hidróxi sal.
FORMULAÇÃO DO SAL A PARTIR DE SEU NOME
Para se determinar a fórmula do sal a partir do seu nome, segue-se os seguintes passos:
Exemplos
a) Sulfato de ferro-III
1º Passo: determinar a fórmula do ácido e da base que originaram o sal.
Ânion sulfato à ác. sulfúrico = H2SO4
Cátion ferro-III à hidróxido de ferro-III = Fe(OH)3
2º Passo: a partir das fórmulas do ácido e da base, determina-se a carga do cátion base e do ânion do ácido.
H2SO4 = SO42- à ânion sulfato
Fe(OH)3 = Fe3+ à cátion ferro-III
3º Passo: juntar o cátion da base com o ânion do ácido.
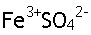
4º Passo: inverter as cargas dos íons para que a soma das cargas se anule.

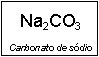
b) Carbonato de sódio
1º Passo: determinar a fórmula do ácido e da base que originaram o sal.
Ânion carbonato à ác. carbônico = H2CO3
Cátion sódio à hidróxido de sódio = NaOH
2º Passo: a partir das fórmulas do ácido e da base, determina-se a carga do cátion base e do ânion do ácido.
H2CO3 = CO32- à ânion carbonato
NaOH = Na+ à cátion sódio
3º Passo: juntar o cátion da base com o ânion do ácido.
Na+ CO32-
4º Passo: inverter as cargas dos íons para que a soma das cargas se anule.
c) Bissulfito de potássio ou hidrogeno sulfito de potássio
1º Passo: determinar a fórmula do ácido e da base que originaram o sal.
Ânion hidrogeno sulfito ou bissulfito à ác. sulfuroso = H2SO3
Cátion potássio à hidróxido de potássio = KOH
2º Passo: a partir das fórmulas do ácido e da base, determina-se a carga do cátion base e do ânion do ácido.
H2SO3 = HSO3- à ânion hidrogeno sulfito ou bissulfito
Nenhum comentário:
Postar um comentário