História
A termoquímica apoia-se sobre duas generalizações. Estabelecida em termos modernos, eles são os seguintes:- Leis de Lavoisier e Laplace (1780): A transferência de energia acompanhando qualquer transformação é igual e opsta a transferência de energia acompanhando o processo reverso.
- Lei de Hess (1840): A transferência de energia acompanhando qualquer transformação é a mesma quando o processo ocorre em um passo ou muitos.
Edward Diaz e Hess também investigaram o calor específico e o calor latente, embora tenha sido Joseph Black quem tenha feito as mais importantes contribuições ao desenvolvimentos das transferências de calor latente.
Calorimetria
A medida de transferências de calor é realizada usando calorimetria, normalmente uma câmara fechada dentro da qual a transferência de calor a ser examinada ocorre. A temperatura da cãmara é monitorada usando-se um termômetro ou termopar, e a temperatura plotada no tempo para dar um gráfico do qual quantidades fundamentais possam ser calculadas. Calorímetros modernos são frequentemente fornecidos com mecanismos automáticos que permitam uma rápida leitura da informação, um exemplo sendo o calorímetro do tipo DSC (do inglês differential scanning calorimeter, calorímetro de carredura diferencial), que permite a calorimetria de varredura diferencial.O calor de reação é o calor 'liberado' ou 'absorvido' por uma reação e pode ser medido em joules ou calorias, a unidade aceita pelo SI (Sistema Internacional de Unidades) é o Joule.
1 caloria (cal) = 4,184 joule (J) 1 quilocaloria (kcal) = 1000 cal 1 quilojoule (KJ) = 1000 J
Sistemas
Diversas definições termodinâmicas são muito úteis em termoquímica. Um sistema é a porção específica do universo que está sendo estudada. Qualquer coisa fora deste sistema é considerado o envolvente ou ambiente. Um sistema pode ser:- um sistema isolado - quando não pode trocar energia ou matéria com suas cercanias, como um reator hermético e isolado termicamente (esta é uma definição teórica, pois sistema algum é absolutamente isolante termicamente, ou, em outras palavras, não existe isolante térmico perfeito;
- um sistema fechado — quando ele pode trocar energia mas não matéria com as cercanias, como um radiador de vapor (pela observação acima, percebemos que por esta definição, todos os sistemas, mesmo fortemente isolados, na prática são sistemas fechados, no máximo);
- um sistema aberto — quando pode trocar tanto energia quanto matéria com as cercanias, como uma panela com água fervente.
Classificação das Reações
Reação Exotérmica
- Reações que se realizam com liberação de energia (calor).
- Reagentes -> Produtos + calor liberado
Reação Endotérmica
- Reações que se realizam com absorção de energia (calor)
- Reagentes + calor -> produtos
Entalpia
Entalpia é uma grandeza física que busca medir a energia em um sistema termodinâmico que está disponível na forma de calor, isso à pressão constante. No Sistema Internacional de Unidades a unidade da entalpia é o joule (J), e esta grandeza é geralmente representada pelo símbolo H. Quando expressa em função da entropia S, número de elementos N, e da pressão P - para o caso de sistemas termodinâmicos mais simples - a entalpia H = H(S,P,N) é, assim como o são as respectivas Transformadas de Legendre, a saber a Energia livre de Helmholtz F = F(T,V,N) , a Energia livre de Gibbs G = G(T,P,N) e a energia interna U = U(S,V,N), uma equação fundamental para os sistemas termodinâmicos, sendo então possível, a partir desta e do formalismo matemático inerente à termodinâmica, obter-se qualquer informação física relevante para o sistema a qual esta encontre-se vinculada.Variação de entalpia
A variação de entalpia (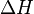 ) é representada por uma proporção com um número fixo de mols.
) é representada por uma proporção com um número fixo de mols.Por exemplo, na reação termoquímica a seguir, a proporção da entalpia (-241,2 kJ/mol) é válida para cada meio mol de
 , para cada um mol de
, para cada um mol de 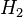 e para cada um mol de
e para cada um mol de  .
.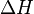 , existem dois tipos de reação:
, existem dois tipos de reação:- Reações exotérmicas: ΔH < 0, há liberação de calor.
- Reações endotérmicas: ΔH > 0 , há uma absorção de calor.
Processos endotérmicos e exotérmicos
O processo endotérmico é aquele que ocorre com absorção de calor. Um exemplo disso: se um pedaço de gelo for deixado sobre a mesa à temperatura ambiente, ele receberá calor do ambiente e isso provocará a fusão do gelo. A transição da água no estado sólido para o estado líquido é um processo que absorve calor – é endotérmico.Outro exemplo disso é: quando um mol de óxido de mercúrio sólido se decompõe, à pressão constante, em um mol de mercúrio líquido e meio mol de oxigênio gasoso, ocorre a absorção de 90,7 kJ de energia do ambiente. Ou, em equação:
O processo exotérmico é aquele que ocorre com liberação de calor. Podemos observar o seguinte exemplo: quando um sistema formado por água líquida é colocado em um congelador, ele perde calor para esse ambiente e, em decorrência disso, ocorre a solidificação da água. Assim, transição da água no estado líquido para o estado sólido é um processo que libera calor – é exotérmico.
Outro exemplo poderia ser: quando um mol de hidrogênio gasoso reage, à pressão constante, com meio mol de oxigênio gasoso para formar um mol de água líquida, ocorre a liberação de 285,8 kJ de energia para o meio ambiente.
Ou, em equação:
Fatores que influenciam o valor do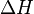
- Quantidade de reagentes e produtos: o valor do
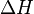 de uma reação varia em função da concentração de cada um de seus participantes. O aumento da concentração provoca um aumento proporcional da variação de entalpia.
de uma reação varia em função da concentração de cada um de seus participantes. O aumento da concentração provoca um aumento proporcional da variação de entalpia.
- Os estados físicos dos reagentes e produtos: substâncias no estado sólido provocam variações de entalpia maiores do que no estado líquido; e estas, maiores do que no estado gasoso.
- Estado alotrópico de reagentes e produtos: cada estado alotrópico tem um valor de entalpia distinto.
Entalpia-padrão
Teoricamente, só é possível calcular o valor do ΔH se forem conhecidas as entalpias absolutas dos reagentes (HR) e dos produtos (HP):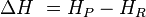 . Tais valores, entretanto, são impossíveis de serem obtidos na prática. Experimentalmente, com o uso do calorímetro só é possível obter valores de ΔH, já que representam o calor perdido ou recebido pelo sistema durante a transformação.
. Tais valores, entretanto, são impossíveis de serem obtidos na prática. Experimentalmente, com o uso do calorímetro só é possível obter valores de ΔH, já que representam o calor perdido ou recebido pelo sistema durante a transformação.É extremamente valioso para o químico conhecer os valores de entalpia para substâncias individuais, pois isso facilita muito o cálculo teórico do ΔH nas milhares de transformações químicas existentes. Por esse motivo, foram determinadas condições de referência para determinação da entalpia das substâncias.
Por exemplo, convencionou-se que toda substância simples no estado padrão (ou seja, no estado físico e alotrópico mais estável a 25°C e 1 atm), tem entalpia igual a zero (0). A partir daí, determinaram-se as entalpias de formação e combustão das substâncias.
Entalpia de formação
Exemplo:
 , é igual a -277,7 kJ.
, é igual a -277,7 kJ.Entalpia de combustão
Exemplo:
 , é igual a -889,5 kJ.
, é igual a -889,5 kJ.Lei de Hess
Em 1840, um físico chamado Germain Henry Hess, com base em seus estudos sobre calores de reação, descobriu que, de um modo geral, quando uma reação se dá em etapas, a soma dos calores de reação correspondentes aos diversos estágios é igual ao calor de reação obtido quando a reação é realizada completamente em uma só etapa.Então, enunciou sua lei: "Quando uma reação química apresenta etapas intermediárias, a variação de entalpia da reação geral equivale à soma das variações de entalpia de cada uma das etapas intermediárias", ou seja, a variação de entalpia em uma reação química depende apenas dos estados inicial e final da reação, a reação principal independe das reações intermediárias.
Podemos utilizar como exemplo simples da aplicação da Lei de Hess a reação de oxidação do carbono. É possível que o carbono se combine com um único átomo de oxigênio, formando o monóxido de carbono:
 .
.Somando
 e
e  , podemos anotar 1 mol deste gás, e o resultado final será:
, podemos anotar 1 mol deste gás, e o resultado final será:Energia de ligação
Outra forma de calcular a entalpia de uma reação química envolve o conceito de energias de ligação, ou seja, aquela relacionada à intensidade da força que une os átomos: energia de ligação é a energia necessária para romper um mol de ligações químicas entre pares de átomos no estado gasoso.Considerando que a quebra de ligações é um processo endotérmico; e que a formação de ligações é um processo exotérmico; podemos calcular o :
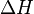 de uma reação química a partir dos valores de energia liberada na quebra de ligações e absorvida na formação de novas ligações. Para tanto, faz-se necessário conhecer os valores-padrão de energia de cada tipo de ligação entre átomos. Calcula-se, então, a variação de entalpia pela diferença entre a energia da quebra das ligações e a energia da formação das ligações.
de uma reação química a partir dos valores de energia liberada na quebra de ligações e absorvida na formação de novas ligações. Para tanto, faz-se necessário conhecer os valores-padrão de energia de cada tipo de ligação entre átomos. Calcula-se, então, a variação de entalpia pela diferença entre a energia da quebra das ligações e a energia da formação das ligações.Exemplo:
- total de ligações quebradas:
- 4 C - H
- 1 H - H
- 1 C = C
- total de ligações formadas:
- 6 C - H
- 1 C - C




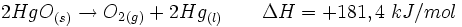







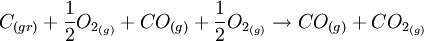



Nenhum comentário:
Postar um comentário