Tipos de reações químicas
Tradicionalmente, as reações químicas podem ser classificadas de acordo com o número de reagentes e produtos em cada lado da equação química que representa a reação:- reações de síntese, composição ou adição;A+b->AB
- reações de análise ou decomposição;AB->A+B
- reações de simples troca ou deslocamento e
- reações de dupla troca
Reação de síntese
Em Química, uma reação de síntese é uma reação química em que dois ou mais reagentes dão origem a um só produto, obedecendo à Lei de Conservação das Massas (Lei de Lavoisier). Estas reações são também conhecidas como reações de composição ou de adição.Neste tipo de reação um único composto é obtido a partir de dois compostos, obedecendo a uma relação do tipo aA + bB → xX .!
Exemplos de reações de adição:

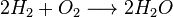
Reação de análise
Em Química, uma reação de análise ou reação de decomposição é uma reacção onde um reagente dá origem a dois ou mais produtos, obedecendo à relação aA → xX + yY.Exemplo de reação de decomposição:

Pirólise (calor):
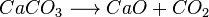
Fotólise (luz):

Eletrólise (corrente elétrica):

Reação de simples troca
Em Química, uma reação de simples troca ou reação de deslocamento ou ainda reação de substituição é uma reação onde há dois reagentes e dois produtos, sendo que um reagente é um elemento químico e o outro é um composto, e entre os produtos há igualmente, um elemento e um composto.Uma reação de simples troca possui a forma A + BC → B + AC.
Existem dois subtipos diferentes de reações de simples troca:
- No primeiro tipo, A e B são metais ou elementos com caráter eletropositivo quando ligados e C é um ânion formado por um ametal somente, um semimetal ou ainda ser um ânion mais complexo.
- No segundo tipo, A e B podem ser ametais ou semimetais e B ser um metal ou elemento com carácter eletropositivo.
Em textos elementares de química é costume empregar-se uma lista simplificada, onde os elementos são postos em ordem decrescente de reatividade. Segue-se abaixo duas listas de reatividade, uma para cada subtipo de reacção de dupla troca:
- Para o deslocamento do cátion:
- Para o deslocamento do ânion:
Um exemplo do primeiro tipo de reação é dado abaixo:

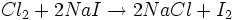
Reação de dupla troca
Em Química, uma reação de dupla troca ou reação de metátese é uma reação onde há dois reagentes, ambos compostos gerando dois produtos, sendo que são igualmente dois compostos, permutando entre si dois elementos ou radicais.Alguns exemplos são:



- menos solúvel
- eletrólito mais fraco
- mais volátil
Ou ainda, pode-se observar os produtos para verificar se a reação de dupla troca ocorre ou não. Neste caso de observação, a reação de dupla troca ocorre efetivamente se, pelo menos um dos produtos da reação for:
- base forte
- água ou peróxido de hidrogênio
- sal insolúvel
- ácido volátil
Nenhum comentário:
Postar um comentário